Предельная одноосновная кислота. Конспект урока "Предельные одноосновные карбоновые кислоты. Понятие о сложных эфирах". Классификация карбоновых кислот
7.doc
515Карбоновые кислоты. Предельные, непредельные и ароматические кислоты. Моно- и дикарбоновые кислоты
Карбоновыми кислотами называются органические соединения, содержащие в молекуле одну или несколько карбоксильных
Карбоксильная группа названа так потому, что в
Ее состав входят карбонильная группа СМ) и гидроксогруппа -ОН. Но свойства карбоксильной группы не представляют собой простой суммы свойств карбонила и гидроксогруппы. Это функциональная группа с присущими ей свойствами.
Однако несколько карбоновых кислот, таких как лимонная, глюконовая и итаконовая кислоты, продолжают производить только путем ферментации, главным образом потому, что их сложные химические структуры трудно получить посредством химического синтеза. Их текущие промышленные применения включают использование в качестве пищевых подкислителей и в производстве полиэфирных смол. Они также могут быть использованы в качестве строительных блоков для синтеза сложных эфиров и биоразлагаемых полимеров.
Коммерчески малеиновый ангидрид является предшественником продуцирования фумаровых, яблочных и янтарных кислот. Уксусная, пропионовая и масляная кислоты представляют собой короткоцепочечные жирные кислоты. Уксусная кислота является химическим продуктом и важным химическим сырьем. Его также можно использовать для производства неагрессивных деицеров, таких как ацетат кальция и ацетат калия. Пропионовая и масляная кислота являются специальными химическими веществами, широко используемыми в пищевой, фармацевтической и химической промышленности.
В зависимости от числа групп -СООН, присутствующих в молекуле кислоты, различают одноосновные (монокарбоновые) кислоты, двухосновные (дикарбоновые) кислоты, многоосновные (поликарбоновые) кислоты.
Так же, как и другие функциональнозамещенные углеводороды, карбоновые кислоты могут быть алифатическими (например, СН 3 СООН), алициклическими (циклогексанкарбоновая кислота С 6 Н 11 СООН) или ароматическими (бензойная кислота С 6 Н 5 СООН).
Акриловая кислота представляет собой химическое сырье с предполагаемой годовой производительностью 2 млн. Молочная кислота является важным химическим веществом с широким спектром применения в пищевой, фармацевтической и косметической промышленности. Оптически чистая молочная кислота используется для синтеза полимолочной кислоты, биоразлагаемого полимера, который имеет большой потенциальный рынок более миллиона метрических тонн в год. Молочную кислоту можно также использовать для синтеза сложных эфиров, таких как этиллактат, которые могут заменить токсичные промышленные растворители.
7.1. Номенклатура
Названия алифатических карбоновых кислот образуются из названий алканов с таким же числом атомов углерода добавлением суффикса -овая. Например:
НСООН Метановая (муравьиная) кислота
СН 3 СООН Этановая (уксусная) кислота
СН 3 СН 2 СООН Пропановая (пропионовая) кислота
Нумерацию цепи начинают с атома углерода карбоксильной группы -СООН:
Глюконовую кислоту получают путем окисления альдегидной группы глюкозы либо бактериями, либо нитчатыми грибами. Это сильный хелатирующий агент, широко используемый в пищевых продуктах и различных промышленных продуктах. В таблице 1 приведены промышленные применения и рыночные размеры этих карбоновых кислот. Производство промышленно важных карбоновых кислот из дешевых и богатых переработанных биоматериалов может уменьшить количество отходов и нашу зависимость от импортных масел. Тем не менее, ферментация также имеет много недостатков, в основном низкую производительность и концентрацию продукта, что может ограничить ее промышленное применение.

В основу номенклатуры ароматических кислот положено название бензойной кислоты. Остальные ароматические кислоты рассматриваются как ее производные:
![]()
Для некоторых кислот прочно утвердились тривиальные названия: муравьиная кислота, уксусная кислота и т.д. (см. выше).
В этой главе сначала будут обсуждаться современные методы ферментации и разделения для производства нескольких карбоновых кислот, а затем обзор технологий экстракционной ферментации, которые могут облегчить ингибирование продукта и улучшить ферментацию для экономичного производства многих промышленно важных карбоновых кислот, которые в настоящее время производятся главным образом нефтехимическими маршрутами.
Карбоксильные группы - ангидрид смешанной функции
Карбоновые кислоты могут присутствовать как неотъемлемая часть гаптена или в виде добавленной части для прекращения действия разделительного рычага. Связывание карбоновой кислоты методом смешанного ангидрида представляет собой простую одностадийную реакцию, которая не требует выделения активного производного. Наиболее распространенными реагентами, используемыми в этом типе реакции, являются изобутилхлорформиат с трибутилом или триэтиламином. Химическая реакция ангидрида смешанной функции показана на рисунке 1.
7.2. Изомерия.
Для монокарбоновых кислот характерна изомерия углеродного скелета. Например, пентановая и 2-метилбутановая кислоты, орто- и метаэтилбензойные кислоты.
^ 7.3. Способы получения
1. Гидролиз сложных эфиров:
2. Под действием сильных окислителей (перманганат калия, дихромат калия, азотная кислота) первичные спирты и альдегиды окисляются до карбоновых кислот.
Модификация карбоксилатов бис-гидразидными соединениями
Химические выходы обычно низкие и могут значительно варьироваться от 1 до 50%. Карбоновые кислоты могут быть ковалентно модифицированы дигидразидом адипиновой кислоты или карбогидразидом с получением стабильных диацилгидразидных связей, которые также содержат удлиненные концевые гидразидные группы. Гидразидные функциональные группы не спонтанно реагируют с карбоксилатными группами так же, как с альдегидными группами. В этом случае карбоновая кислота должна быть сначала активирована другим соединением, которое делает его реакционноспособным по отношению к нуклеофилам.
3. Окисление кетонов (при этом образуются кислоты с меньшим числом атомов углерода в молекуле, чем в исходном кетоне).
4. Окисление алкилбензолов кислым раствором перманганата калия.
5.1,1,1 - тригалогеналканы гидролизуются в щелочном растворе до карбоновых кислот.

Этот активный эфир может дополнительно взаимодействовать с нуклеофилами, такими как гидразид, с получением стабильного имидного продукта. Большинство белков содержат обилие карбоксильных групп из С-концевых функциональных групп и боковых цепей аспарагиновой и глутаминовой кислот. Эти группы легко модифицируются бис-гидразидными соединениями с получением полезных активированных гидразидом производных. Для получения этих модификаций использовали карбогидразид и дигидразид адипиновой кислоты с использованием карбодиимидной реакции.
6. Синтез карбоновых кислот с одновременным увеличением длины углеводородной цепи можно проводить с использованием реактивов Гриньяра.
7. Взаимодействие солей органических кислот с серной кислотой при нагревании:
8. Окисление бутана (способ, разработанный советским ученым Н. М. Эмануэлем):
^ 7.4. Физические свойства
Растворите 5 мг белка или другой макромолекулы, которая должна быть модифицирована на миллилитр вышеуказанного раствора. Очистите модифицированный белок путем диализа или гель-фильтрации с использованием обессоливающей смолы. Однако более высокий выход уксусной кислоты может быть получен непосредственно из сахаров путем анаэробной ферментации с гомоацетогенами. Молочнокислые бактерии считаются безопасными организмами для производства и сохранения ферментированных продуктов. Они превращают определенные сахара в органические кислоты.
Из данных табл. 39 видно, что с увеличением молекулярной массы кислот температура кипения их возрастает.
Низшие гомологи карбоновых кислот - жидкости, обладающие резким запахом, растворимы в воде, однако растворимость их понижается с увеличением молекулярной массы. Высшие представители гомологического ряда - твердые тела, в воде нерастворимы и запаха не имеют.
Молочная кислота и уксусная кислота, два основных типа произведенных кислот, также обеспечивают аромат. Молочная кислота играет прямую роль в аромате хлеба. Молочная кислота широко используется в пищевой и химической промышленности. Пропионовая кислота используется при производстве гербицидов, химических промежуточных продуктов, ароматизаторов искусственных фруктов, фармацевтических препаратов, пропионата ацетата целлюлозы и консервантов для пищевых продуктов, кормов для животных и зерен. Масляная кислота широко используется в производстве напитков, пищевых продуктов и фармацевтической промышленности.
Молекулы карбоновых кислот образуют димеры (за счет двух водородных связей):


Как следствие, эти соединения имеют температуры кипения выше, чем у спиртов близкой молекулярной массы (см. табл. 39). Образованием водородных связей обусловлена и растворимость первых членов гомологического ряда кислот в воде.
Его производные играют важную роль в пластической и текстильной промышленности. Масляную кислоту можно извлечь из масла, но этот метод слишком дорог. Эти кислоты в основном производятся нефтехимическими путями, но растет интерес к их производству из биомассы. анаэробная ферментация.
Лимонная кислота широко используется в пищевых продуктах, напитках и фармацевтических препаратах для обеспечения кислотности, вкуса и солеобразования. Соли цитрата использовались в качестве связующих агентов и в качестве антикоагулянта для защиты крови. Их антиоксидантные свойства могут снизить окисление металлов в катализируемом окислении в жирах и маслах. Глюконовая кислота и ее соли имеют широкое применение в пищевой, фармацевтической и медицинской промышленности.
^ 7.5. Химические свойства
Кислотность и ее зависимость от строения
Важнейшее свойство карбоксильной группы - ее кислотность. То, что нам уже известно о влиянии соседних атомов на кислотность гидроксила, позволяет легко понять причины повышенной кислотности карбоксильной группы. Углерод СООН-группы, несущий частичный положительный заряд, для компенсации этого заряда перетягивает к себе электроны соседних связей, в том числе и связи С-О. Это, в свою очередь, вызывает сдвиг электронов связи О-Н в направлении кислорода и, таким образом, повышает положительный заряд на атоме водорода гидроксильной группы:
Его сильное хелатирующее свойство также делает его хорошим средством для мойки стекла и металла в промышленности. Пируват является одним из наиболее важных метаболитов в центральном метаболизме живых клеток. Он является предшественником синтеза аминокислот и играет ключевую роль в качестве промежуточного продукта гликолиза. Пирувиновая кислота и ее соли являются важными химическими веществами, используемыми в агрохимической, косметической, фармацевтической и пищевой промышленности. Янтарная кислота и ее соли могут быть товарными химикатами.

Существует и еще одна причина повышенной кислотности карбоксильной группы -мезомерия. Отрицательный заряд образующегося при диссоциации аниона не сосредоточен на одном из атомов кислорода (а), а поделен между ними (б):

Его можно использовать в качестве промежуточного продукта для получения 1, 4-бутандиола и пирролидинонов, которые важны для производства пластмасс и растворителей. Вместо этого, будучи более липофильным, чем уксусная кислота, они, как считается, проникают в клетки в основном за счет пассивной, неактивированной диффузии через плазматическую мембрану.
Устойчивость к пропионовой, сорбиновой и бензойной кислотам включает в себя не потерю канала для диффузного входа кислоты в клетки, а индукцию активности, катализирующую активную экструзию аниона-консерванта из клетки. Однако до сих пор ни одна протеинкиназа не была признана необходимой для этой активации. В живых клетках его активность может быть легко визуализирована как энергозависимая экструзия флуоресцеина. Рабочая модель заключается в том, что она связывает кислотные анионы, включенные во внутренний листочек плазматической мембраны, затем переносит их на противоположную сторону мембраны до их высвобождения в водную фазу периплазмы.
На кислотность карбоксильной группы будет влиять и природа радикала, с которым эта группа связана: если этот радикал обладает способностью оттягивать на себя электроны (отрицательный индуктивный эффект -I), то кислотность будет возрастать. Так, хлоруксусная кислота диссоциирована примерно в 100 раз сильнее, чем уксусная, а трифторуксусная кислота по своей степени диссоциации не уступает сильным минеральным кислотам. Это проявление отрицательного индуктивного эффекта галогенов - их способности оттягивать электроны. Подобным же отрицательным индуктивным эффектом обладают и другие группы; по своей силе они располагаются в следующий ряд :
Кокристильные системы, образованные карбоновыми кислотами
Такой активный отток может снизить внутриклеточный уровень кислоты, исходя из того, что полярные группы на этих карбоксилатных анионах замедлят любое неуравновешенное «перевертывание» этих образований через липидный бислой. Функциональность карбоновой кислоты присутствует в большом количестве соединений, имеющих фармацевтический интерес, и часто представляет собой одну из точек взаимодействия реагентов в супрамолекулярном синтоне. Например, анализ структур, опубликованных в Кембриджской структурной базе данных, был проведен для оценки иерархии карбомовой кислоты и супрамолекулярных гетеросинтонов спирта в контексте активных фармацевтических ингредиентов.
(CH 3) 3 N >NO 2 >CN>СНО>СО>F>Cl>Br>I>COOH>OH>NH 2 >H
Существуют группы и с положительным индуктивным эффектом (I), т.е. отталкивающие электроны. По силе действия их можно расположить в следующий ряд:
Н<СН 3 <С 2 Н 5 <СН(СН 3) 2 <С(СН 3) 3
Из-за положительного индуктивного эффекта метильной группы степень диссоциации уксусной кислоты меньше, чем муравьиной, хотя здесь действуют и другие факторы.
Так как образование кокриналов пироксикама может привести к увеличению количества биодоступности лекарственных веществ, в скрининговых экспериментах были идентифицированы 50 уникальных кокристалов, содержащих пироксикам и гостевую карбоновую кислоту. Из исследования скрининга выяснилось, что все 23 гостевые молекулы пытались сформировать по крайней мере один кокристалл, а другие условия изоляции привели к образованию трех известных полиморфов пироксикама. Сокристаллические продукты можно разделить на три группы на основе их спектров комбинационного рассеяния, которые отражают присутствующий в кокристале пироксикамовый таутомер, а также наличие или отсутствие сильного донора водородной связи, взаимодействующего с карбоксильной группой пироксикаммазида.
1) В растворах карбоновые кислоты диссоциируют:
^ R-COOH RCOC - Н
Вследствие кислой реакции раствора они изменяют цвет индикаторов-красителей.
2) Как и неорганические кислоты, карбоновые кислоты вступают во все реакции, обусловленные наличием протона.
Они взаимодействуют с активными металлами
2RCOOH Zn=(RCOO) 2 Zn H 2 с основаниями
Анализ кристаллической структуры был использован для доказательства того, что карбоновые кислоты не ионизировались в кокристаллах, а пироксикам присутствовал в виде цвиттерионного таутомера. Наряду с традиционными методами кристаллизации, для получения кокристаллического продукта использовали высокопроизводительные методы скрининга и процедуры измельчения растворителя. Кристаллические структуры свободных кислот и кокриналов были охарактеризованы лентами с водородным связыванием того же типа, но твердые вещества не были изоструктурными из-за значительных различий в упаковке лент.
2RCOOH Са(ОН) 2 =(RCOO) 2 Ca 2Н 2 С и с основными оксидами
2RCOOH MgO=(RCOO) 2 Mg Н 2 O
Поскольку карбоновые кислоты являются слабыми кислотами, их соли в растворе сильно гидродизованы. Органические кислоты вытесняются из их солей при действии более сильных минеральных кислот, например
2C 2 H 5 COONa H 2 SO 4 =2C 2 H 6 COOH Na 2 SO 4
За исключением муравьиной кислоты, карбоновые кислоты устойчивы к действию концентрированных минеральных кислот. Муравьиная кислота разлагается под действием концентрированной серной кислоты с образованием воды и оксида углерода (II).
3) В присутствии красного фосфора карбоновые кислоты взаимодействуют с галогенами с образованием -галогензамещенных кислот:
4) Карбоновые кислоты способны восстанавливаться под действием комплексных гидридов (например, LiAlH 4).
5) Окисление кислот. Предельные кислоты с нормальной углеродной цепью окисляются трудно. Кислоты с третичным атомом углерода дают при окислении оксикислоты (см. Оксикислоты). В чистом кислороде все кислоты окисляются до СО 2 и Н 2 О.
6) Образование функциональных производных кислоты. Кислоты способны к образованию многочисленных производных, получающихся в результате реакций замещения в карбоксильной группе. Эти производные можно разбить на три основные типа:

Рассмотрим подробнее образование функциональных производных кислот
7.5.1. Соли
Реакции образования солей карбоновых кислот при взаимодействии с металлами, основными оксидами, гидроксидами и солями более слабых кислот (карбоновые кислоты вступают в те же реакции, что и минеральные кислоты):

Выделение газа при обработке органического вещества насыщенным раствором гидрокарбоната натрия - качественная реакция на карбоновые кислоты, она позволяет отличить их от фенолов.
Ацетат натрия в водном растворе подвергается гидролизу (но в меньшей степени, чем фенолят):
CH 3 COO - Na Н 2 О СН 3 СОО - Н Na ОН -
Степень гидролиза ацетатов меди, цинка, железа больше, чем ацетата натрия.
Соли карбоновых кислот - ионные соединения, поэтому они практически нелетучи и при комнатной температуре - твердые кристаллические вещества. Соли низших кислот растворимы в воде, поскольку группа -СОО - образует водородные связи с молекулами воды. Соли высших кислот, имеющие большую по размерам углеводородную группу, растворимы в воде гораздо хуже.
7.5.2. Ангидриды
Общая формула ангидридов R-СО-О-СО-R". Они являются продуктами дегидратации кислот. При их образовании молекула Воды отщепляется от двух молекул карбоновой кислоты (для этого действуют оксидом фосфора (V) Р 2 О 5 или нагревом):

Ангидриды - очень реакционноспособные соединения. Ангидриды - летучие жидкости, с резким запахом. Большое техническое значение имеет уксусный ангидрид. Это жидкость с резким запахом, t квп =140°С.
Наибольшие количества его расходуются для получения ацетатного волокна, негорючей кинопленки. Кроме того, он применяется для синтеза фармацевтических препаратов, красителей.
7.5.3. Галогенангидриды
Галогенангидриды кислот получаются при действии на кис-доты неорганических галогенсодержащих веществ, например хлорида фосфора (V) РСl 5:
Галогенангидриды, как и ангидриды, очень реакционноспособные соединения. Они служат, в частности, для введения кислотного радикала (ацила) R-СО- в другие соединения. Такие превращения называются реакциями ангидридов и хлорангидридов со спиртами, приводят к образованию сложных эфиров:

Не случайно приведенные выше примеры показывают получение сложных эфиров из вторичных и третичных спиртов. Дело в том, что обычной реакцией этерификации такие сложные эфиры получаются плохо (работа Н. А. Меншуткина): разветвленный углеродный скелет создает пространственные препятствия для реакций.
Повышенная реакционноспособность хлорангидридов в реакции этерификации объясняется тем, что у них под действием отрицательного индукционного эффекта хлора оттянуты электроны связи ССl и тем самым повышен положительный заряд на карбоксильном углероде:
Такова же природа повышенной активности ангидридов; причиной является отрицательный индукционный эффект атома кислорода:

Действуя хлорангидридом на соль кислоты, можно получить ангидрид, что и используется в лаборатории:
СН 3 СОСl NaOOCCH 3 (СН 3 СО) 2 O NaCl СН 3 СОСl КООСС 4 Н 9 СН 3 СО-O-ОС-С 4 Н 9 КСl
При действии воды ангидриды и галогенангидриды легко гидролизуются с образованием кислот:
СН 3 СОСl Н 2 OСН 3 СООН НСl
(С 6 Н 5 СО) 2 O Н 2 O2С 6 Н 5 СООН
Особенно легко эти реакции идут в присутствии щелочей.
^ 7.5.4. Сложные эфиры
Главным способом получения сложных эфиров является реакция этерификации - взаимодействие карбоновой кислоты со спиртом в присутствии минеральной кислоты, служащей катализатором. Механизм этой реакции хорошо известен.
Реакция начинается с того, что протон (образовавшийся при диссоциации минеральной кислоты) присоединяется к карбонильному кислороду, имеющему частичный отрицательный заряд:

В результате на атоме углерода карбоксильной группы появляется положительный заряд, повышающий его электрофильную активность. За счет этого заряда осуществляется взаимодействие со свободной электронной парой атома кислорода спирта:

Промежуточный комплекс стабилизируется путем отщепления воды и протона:

Все стадии этого процесса обратимы, поэтому обратима и вся реакция в целом. Именно присоединение протона активизирует карбоксильную группу и делает возможным последующее взаимодействие со спиртами. Таким образом, становится ясно и то, что атом кислорода спирта остается в составе сложного эфира.
Важнейшим химическим свойством сложных эфиров является гидролиз. Как и реакция этерификации, гидролиз катализируется протонами, а кроме того (в отличие от этерификации!), гидролиз ускоряется под действием оснований. Щелочной гидролиз, в отличие от кислотного, - реакция необратимая, т.к. образующаяся карбоновая кислота превращается в соль, которая со спиртом не реагирует.
7.5.5. Амиды
Кроме сложных эфиров и солей, ангидридов и галогенангидридов, известны и другие функциональные производные карбоновых кислот - амиды.
В амидах атом азота проявляет М (мезомерный) и -I (индуктивный) эффекты, причем М сильнее, а -I слабее, чем группа ОН в кислотах или группа OR в сложных эфирах (вследствие меньшей электроотрицательности азота по сравнению с кислородом). В результате:

1) В амидной группе заряд на атоме углерода меньше, чем в карбоксильной или сложноэфирной группах, а степень сопряжения выше (вспомним: сопряжение стабилизирует молекулу). Это приводит к низкой химической активности амидов. Например, их гидролиз до соответствующих кислот идет значительно труднее, чем гидролиз сложных эфиров (необходимо нагревание с достаточно концентрированной кислотой или щелочью):

2) На атоме азота электронная плотность сильно понижена. Поэтому амиды, в отличие от аминов, не обладают свойствами оснований.
3) Полярность связи N-Н увеличена, заряд - на кислороде оказывается также высоким (выше, чем в кислотах). Поэтому амидные группы образуют между собой водородные связи (в отличие от сложных эфиров, ангидридов, галогенангидридов и нитрилов). Это приводит к высоким температурам плавления и кипения этих веществ (ацетамид: t пл = 82°С, t кип = 221°С). Большинство амидов (кроме низших) - твердые вещества, обладающие слабым запахом. Амиды лучше других производных карбоновых кислот растворяются в воде.
^ Способы получения амидов
1) Сухая перегонка аммониевых солей карбоновых кислот. При нагревании до 200°С аммониевая соль дегидратируется с образованием амида:

2) Действие аммиака или амина на сложный эфир:

Значение амидов
Белки - это природные полиамиды; в промышленности выпускаются искусственные волокна - полиамиды, например капрон.
^ 7.6. Сложные эфиры.
Строение
Сложные эфиры содержат функциональную группу:

Где R и R" - одинаковые или различные алкильные или арильные радикалы.
Сложные эфиры также можно рассматривать как производные кислот, у которых атом водорода в карбоксильной группе замещен на углеводородный радикал (R"):
R-CO-OHR-CO-O-R"
Номенклатура
Название сложного эфира образуют от названий спирта и кислотного остатка, содержащихся в этом эфире. Например,

Получение
Сложные эфиры можно получать при взаимодействии карбоновой кислоты и спирта (реакция этерификации). Эта обратимая реакция разобрана в §§ 7.5.3, 7.5.4
Более удобный метод представляет собой взаимодействие галогенангидрида карбоновой кислоты с алкоголятом натрия:
R-C(O)-X NaOR"=R-C(O)-OR" NaX
Физические свойства
Сложные эфиры R-C(O)-OR" с небольшими радикалами R и R" представляют собой жидкости. Их плотность меньше единицы. Сложные эфиры плохо растворимы в воде, хорошо растворимы в диэтиловом эфире, метаноле, этаноле. В воде хорошо растворяются эфиры, образованные низшими кислотами и спиртами. Сложные эфиры обладают приятным запахом, что используется в парфюмерии и кондитерской промышленности.
^ Химические свойства
1) Гидролиз сложных эфиров (см. §7.5.4). Гидролиз под действием воды - обратимая реакция:
R-CO-OR" Н 2 O H R-CO-OH R"OH
2) Восстановление сложных эфиров водородом:
R-CO-OR" [Н]R-CH 2 -OH R"OH
3) Взаимодействие сложных эфиров показано на схеме.
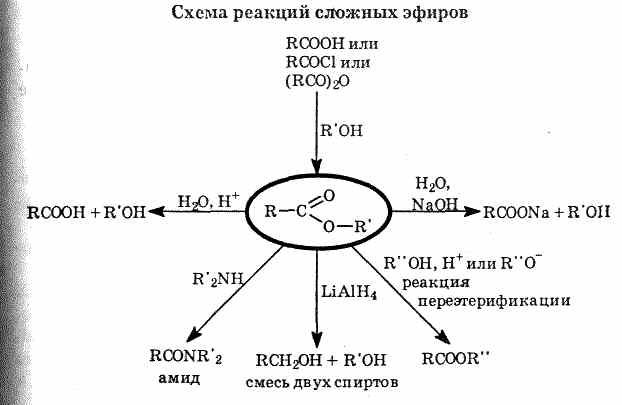
Применение
Так как сложные эфиры обладают приятным запахом, они используются в косметической и пищевой промышленности в качестве ароматизаторов. Сложные эфиры распространены в природе - они, в частности, обуславливают запах многих плодов, ягод, цветов. Например:
Многие сложные эфиры применяются в качестве растворителей, для синтеза ряда органических соединений.
Некоторые сложные эфиры используются в медицине: изоамилнитрит ослабляет приступы при стенокардии, этилнитрит расширяет периферические кровеносные сосуды.
7.7. Жиры
Состав и строение
Жиры - это смеси сложных эфиров, образованных трехатомным спиртом глицерином и высшими жирными кислотами. Общая формула жиров, где R - радикалы высших жирных кислот:

Чаще всего в состав жиров входят предельные кислоты: пальмитиновая С 15 Н 31 СООН и стеариновая С 17 Н 35 СООН, и непредельные кислоты: олеиновая С 17 Н 33 СООН и линолевая С 17 Н 31 СООН.
Общее название соединений карбоновых кислот с глицерином - триглицериды.
Состав и строение жиров были установлены еще в начале XIX века благодаря работам французских химиков Шевреля и Бертло. Шеврель установил, что жиры и масла при длительном нагревании с водой и щелочью разлагаются с выделением карбоновых кислот и глицерина. Бертло синтезировал жиры из глицерина и карбоновых кислот:

Тристеарид наравне с глицеридами пальмитиновой и олеиновой кислот чаще всего встречается в жирах. Если в состав жира входят различные кислоты, то образуются смешанные триглицериды. Так, в коровьем масле содержатся глицериды олеиновой, пальмитиновой и стеариновой кислот.
Твердые жиры образованы предельными кислотами нормального строения, главным образом пальмитиновой и стеариновой. Это - животные жиры. Жидкие жиры - масла, в большинстве случаев растительного происхождения; в состав их молекул входят остатки непредельных кислот: олеиновой, линолевой и др.
Получение
Большое практическое значение в настоящее время имеет получение жиров из природных источников животного и растительного происхождения.
Физические свойства
Все жиры (твердые и жидкие) легче воды и нерастворимы в ней. Хорошо растворяются в бензине, эфире, тетрахлориде углерода, сероуглероде, дихлорэтане и других растворителях. Жиры хорошо впитываются бумагой и кожей.
Химические свойства
^ Гидролиз жиров в технике (омыление жиров) Жиры имеют большое техническое значение: они служат необходимым материалом для получения мыла и глицерина. Мылами называют соли высших жирных кислот, растворы которых обладают моющим действием. Наибольшее распространение имеют натриевые мыла, применяющиеся в технике и в быту в качестве моющих средств. Сущность мыловарения состоит в омылении жиров раствором гидроксида натрия при нагревании. При этом жиры расщепляются на глицерин и мыло.
Гидролиз, или омыление, жиров происходит под действием воды (обратимо) или щелочей (необратимо):

Итак: мыла - это соли высших карбоновых кислот. Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли - жидкие мыла.
Для разделения образовавшейся смеси глицерина и мыла добавляют водный раствор хлорида натрия, в котором, как в электролите с одноименным ионом натрия, мыло растворяется очень плохо. В результате происходит расслаивание: сверху слой раствора мыла, а снизу раствор глицерина и хлорида натрия. Раствор мыла разливают в формы, где оно затвердевает. Водный раствор глицерина упаривают, отделяют от хлорида натрия и очищают перегонкой.
Для варки мыла используют различные жиры: сало, масло и др. В настоящее время для производства мыла используется непищевое сырье. Необходимые для этого кислоты получают в промышленном масштабе путем окисления углеводородов, входящих в состав парафина.
^ Гидрогенизация жиров
Гидрогенизацией жиров называется процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жиров. При этом остатки непредельных кислот переходят в остатки предельных кислот, и жиры из жидких превращаются в твердые.
Жидкие растительные масла подвергаются гидрированию, сущность которого состоит в переводе жидких глицеридов непредельных кислот в твердые глицериды предельных кислот путем присоединения водорода под давлением в присутствии катализатора. В настоящее время гидрирование растительных масел составляет целую отрасль промышленности, выпускающую пищевые и технические твердые жиры. При гидрировании водород присоединяется по месту двойной связи, превращая масло в твердый жир:

Твердые гидрогенизированные жиры имеют преимущества перед жидкими: они удобнее при транспортировке, более стойки при хранении. Твердые гидрогенизированные жиры (саломас) используются не только для технических целей, но и для производства маргарина.
^ Превращение жиров пищи в организме
Особенно велико значение жиров как продуктов питания. Они нерастворимы в воде и не могут всасываться в организм из органов пищеварения. Под влиянием фермента (катализатора) жиры расщепляются на глицерин и кислоты, из которых организм вырабатывает свои жиры, свойственные данному организму. Синтезированный таким образом жир поступает в другие ор-
Ганы и ткани организма, где в процессе обмена веществ в клетках снова подвергается гидролизу и затем постепенному окислению до СО 2 и Н 2 О. Эти экзотермические процессы внутри организма дают энергию, необходимую для поддержания жизнедеятельности.
Из важнейших пищевых веществ - белков, жиров и углеводов - жиры обладают наибольшим запасом энергии.
Масла по своей способности изменяться на воздухе подразделяются на невысыхающие (оливковое, миндальное), высыхающие (льняное, конопляное) и полувысыхающие (подсолнечное, хлопковое). Высыхающие масла в большом количестве применяются для приготовления олифы - густой жидкости, образующей быстро сохнущую пленку. Олифа используется для приготовления масляных красок и лаков и в типографском деле.
^ 7.8. Мыло. Синтетические моющие средства
Как было уже отмечено в §7.7, омыление - щелочной гидролиз жиров, приводящий к образованию мыла.
Этот процесс известен с древнейших времен, когда животные жиры кипятили с водой и древесной золой, содержащей карбонат калия.
Натриевые мыла ограниченно растворимы в воде и могут быть получены в виде твердых брикетов. Калиевые мыла лучше растворимы и используются в шампунях и кремах для бритья. Кальциевые и магниевые соли жирных кислот в воде не растворяются, поэтому мыла нельзя использовать в жесткой воде, содержащей ионы кальция Са 2 и магния Mg 2 . Такая вода должна быть предварительно смягчена (кипячением или обработкой содой Na 2 CO 3 ; или пропусканием через колонку с алюмосиликатом натрия и др.).
Мыла обладают моющими свойствами: отмываемая поверхность смачивается раствором мыла, вследствие чего частицы загрязнения переходят в объем раствора. В растворе частицы стабилизируются, что предохраняет их от слипания (коагуляции) и повторного осаждения на отмываемую поверхность.
Синтетические моющие средства (CMC) - это натриевые соли сульфокислот. Например:

CMC имеют преимущество перед мылами, т.к. могут использоваться в жесткой воде за счет добавок, умягчающих воду.
Существенным недостатком CMC является их способность накапливаться в окружающей среде и загрязнять ее. В отличие от карбоновых кислот, сульфокислоты не разлагаются микроорганизмами и накапливаются в. водоемах, что ведет к гибели водной флоры и фауны.
^ 7.9. Моно- и дикарбоновые кислоты
В зависимости от числа карбоксильных групп, входящих в состав молекулы, карбоновые кислоты делятся на:
Одноосновные (монокарбоновые) кислоты,
Двухосновные (дикарбоновые) кислоты,
Многоосновные (поликарбоновые) кислоты.
^ 7.9.1. Монокарбоновые кислоты
Одноосновные карбоновые кислоты содержат одну карбоксильную группу, связанную с углеводородным радикалом (предельным, непредельным, ароматическим).
Одноосновные предельные карбоновые кислоты Рассмотрим свойства кислот на примере муравьиной, уксусной, пальмитиновой и стеариновой кислот.
^ Муравьиная кислота
в природе встречается в жгучей крапиве, в муравьях; впервые была выделена путем обработки водяным паром муравьев.
В настоящее время ее получают действием оксида углерода СО на гидроксид натрия при повышенной температуре и давлении. При этом получается формиат натрия:
СО NaOHNaCOOH
2NaCOOH H 2 SO 4 2НСООН Na 2 SO 4
Муравьиная кислота отличается по своему строению от других карбоновых кислот. В ее молекуле
Находится карбонил, связанный с водородом, т.е. альдегидная группе

Действительно, муравьиная кислота проявляет и свой-
Ства альдегидов. Она легко окисляется аммиачным раствором оксида серебра, т.е. является сильным восстановителем.
Восстановительные свойства муравьиной кислоты можно проследить на примере взаимодействия с сулемой HgCl 2:
НСООН 2HgCl 2 Hg 2 Cl 2 2НСl СO 2
Образующаяся каломель Hg 2 Cl 2 избытком НСООН восстанавливается до металлической ртути:
НСООН Hg 2 Cl 2 2Hg 2НСl СO 2
^ Уксусная кислота

Типичный представитель карбоновых кислот, в состав которой входят углеводородный радикал и карбоксил. Безводная уксусная кислота - бесцветная жидкость с резким запахом. При охлаждении до 16,6°С застывает в кристаллическую массу, напоминающую кристаллы льда. Поэтому безводную уксусную кислоту часто называют ледяной уксусной кислотой.
Один из основных промышленных способов получения уксусной кислоты состоит в окислении ацетальдегида кислородом воздуха в присутствии марганцевых катализаторов:

В нашей стране разработан способ получения уксусной кислоты путем окисления н-бутана при 145°С и давлении в 50 атм с выходом кислоты до 80%.
2СН 3 -СН 2 -СН 2 -СН 3 5O 2 4СН 3 СООН 2Н 2 О
В больших количествах уксусная кислота применяется при синтезах различных полимеров, красителей, лекарственных средств, в пищевой и парфюмерной промышленности, в медицине.
Хлоруксусная кислота применяется в производстве гербицидов, с помощью которых производят «химическую» обработку пшеницы, ржи и других злаков. Уксусный ангидрид используется при изготовлении ацетатного волокна.
Пальмитиновая C 15 H 31 COOH и стеариновая С 17 Н 35 СООН кислоты - высшие предельные одноосновные карбоновые кислоты. Это твердые белые вещества, нерастворимые в воде. Молекулы обеих кислот состоят из неразветвленных цепей, в которых атомы углерода соединены -связями.
Высшие карбоновые кислоты обладают теми же химическими свойствами, что и низшие. Так, при взаимодействии с щелочами они образуют соли:

Соли щелочных металлов высших предельных карбоновых кислот обладают моющим действием и составляют основу обычного мыла. Калиевые соли этих кислот дают жидкие мыла, а натриевые - твердые мыла.
Соли высших карбоновых кислот легко подвергаются гидролизу:
C 17 H 35 COONa НОНС 17 Н 35 СООН NaOH или С 17 Н 35 СОO - НОНС 17 Н 35 СООН ОН -
^ Непредельные карбоновые кислоты
Известны кислоты, в углеводородном радикале которых содержится одна или несколько двойных связей. Химические свойства непредельных карбоновых кислот обусловлены как свойствами карбоксильной группы, так и свойствами двойной связи.
В группе непредельных кислот чаще всего используют эмпирические названия: СН 2 =СН-СООН - акриловая (пропеновая) кислота; СН 2 =С(СН 3)-СООН - метакриловая (2-метилпропеновая) кислота.
Изомерия в группе непредельных одноосновных кислот связана с:
А) изомерией углеродного скелета;
Б) положением двойной связи;
В) цис- и транс-изомерией.
Рассмотрим способы получения непредельных монокарбоновых кислот: 1) Дегидрогалогенирование галогензамещенных кислот:

Низшие непредельные кислоты - жидкости, растворимы в воде, с сильным острым запахом; высшие - твердые, нерастворимы в воде, бег запаха.
Специфическими свойствами обладают кислоты с близко расположенной от карбоксильной группы двойной связью --,-непредельные кислоты. У этих кислот присоединение галогеноводородов и гидратация идет против правила Марковникова: СН 2 =СН-СООН HBrCH 2 Br-CH 2 -COOH При осторожном окислении образуются диоксикислоты: СН 2 ^ -СН-СООН [О] Н 2 OНО-СН 2 -СН(ОН)-СООН При энергичном окислении происходит разрыв двойной связи и образуется смесь разных продуктов, по которым можно установить положение двойной связи.
Олеиновая С 17 Н 33 СООН - одна из важнейших высших непредельных кислот. Это бесцветная жидкость, затвердевающая на холоде. Ее структурная формула:
Олеиновая кислота вместе со стеариновой и пальмитиновой кислотами входит в состав растительных и животных жиров в виде сложных эфиров глицерина.
Наличие двойной связи у олеиновой кислоты определяет и ее химические свойства как непредельного соединения. Так, присоединив по месту двойной связи водород, она переходит в стеариновую кислоту:
C 17 H 33 COOH H 2 C 17 H 35 COOH
^ 7.9.2. Дикарбоновые кислоты
Дикарбоновые кислоты - это производные углеводородов, которые содержат в молекуле две группы-СООН. Для них наиболее часто используются эмпирические названия:

^ Способ получения : Окисление двухатомных спиртов - гликолей:
НО-СН 2 -СН 2 -ОН [О]НООC-СООН Н 2 О
Физические и химические свойства. Все дикарбоновые кислоты представляют собой твердые кристаллические вещества, растворимые в воде.
Взаимное влияние атомов в молекулах дикарбоновых кислот приводит к тому, что они являются более сильными кислотами,
Чем одноосновные. Двухосновные кислоты вступают во все реакции, свойственные одноосновным кислотам, давая два ряда производных.
Специфика их строения приводит к присущим им реакциям образования циклических ангидридов:

Хотя аминогруппа и обладает слабым отрицательным индуктивным эффектом, однако она не увеличивает кислотности карбоксила в соответствующих соединениях (аминокислотах), а придает им амфотерные свойства из-за своей основности
Часть молекулы кислоты без гидроксильной группы называется ацильным, или кислотным, радикалом. Название радикалов происходит от латинского названия кислоты и окончания -ил. Радикал уксусной кислоты (acidium aceticum) - ацетил СН 3 С(О)-
Карбоновыми кислотами называются производные углеводородов, которые содержат одну или несколько карбоксильных групп – С = О.
Карбоксильная группа представляет собой сочетание карбонильной и гидроксильной групп: – С = О + – С – – С = О.
карбо нил + гидроксил карбоксил.
Карбоновые кислоты – продукты окисления альдегидов, которые, в свою очередь, являются продуктами окисления спиртов. На кислотах завершается процесс окисления (с сохранением углеродного скелета) в следующем ряду:
углеводород спирт альдегид карбоновая кислота.
Классификация карбоновых кислот
I. По характеру радикала
II. В зависимости от числа карбоксильных групп
Карбоновые кислоты, содержащие в углеводородном радикале более 10 атомов углерода, относят к высшим кислотам .
1.1. Предельные одноосновные карбоновые кислоты
Общая формула предельных одноосновных карбоновых кислот С n H 2 n +1 COOH .
Номенклатура карбоновых кислот
Для карбоновых кислот более приняты тривиальные названия, возникновение которых обычно связано с природным источникам, из которых они выделены или синтезированы. Так, муравьиная кислота содержится в выделениях муравьев, масляная – в коровьем масле, щавелевая – в ряде растений; никотиновая кислота получена впервые окислением никотина, янтарная – янтаря, о-фталевая – нафталина и т.д.
Международные названия карбоновых кислот образуются от названия соответствующего углеводорода с добавлением окончания “– овая кислота” . Но такие названия употребляются довольно редко и лишь в тех случаях, когда тривиального названия кислота не имеет.
Таблица 16.4.
Гомологический ряд карбоновых кислот
|
Число атомов С |
Карбоновая кислота |
Название кислоты |
|
|
Тривиальное |
Номенклатура ИЮПАК |
||
|
муравьиная |
метановая |
||
|
СН 3 – СООН |
уксусная |
этановая |
|
|
СН 3 – СН 2 – СООН |
пропионовая |
пропановая |
|
|
СН 3 – СН 2 – СН 2 – СООН |
масляная |
бутановая |
|
|
СН 3 – (СН 2) 2 – СН 2 – СООН |
валериановая |
пентановая |
|
|
СН 3 – (СН 2) 3 – СН 2 – СООН |
капроновая |
гексановая |
|
|
СН 3 – (СН 2) 4 – СН 2 – СООН |
гептановая |
||
|
СН 3 – (СН 2) 5 – СН 2 – СООН |
каприловая |
октановая |
|
|
СН 3 – (СН 2) 6 – СН 2 – СООН |
пеларгоновая |
нонановая |
|
|
СН 3 – (СН 2) 7 – СН 2 – СООН |
каприновая |
декановая |
|
|
СН 3 – (СН 2) 8 – СН 2 – СООН |
ундециловая |
ундекановая |
|
|
СН 3 – (СН 2) 9 – СН 2 – СООН |
лауриновая |
додекановая |
|
|
СН 3 – (СН 2) 10 – СН 2 – СООН |
тридециловая |
тридекановая |
|
|
СН 3 – (СН 2) 11 – СН 2 – СООН |
миристиновая |
тетрадекановая |
|
|
СН 3 – (СН 2) 12 – СН 2 – СООН |
пентадециловая |
пентадекановая |
|
|
СН 3 – (СН 2) 13 – СН 2 – СООН |
пальмитиновая |
гексадекановая |
|
|
СН 3 – (СН 2) 14 – СН 2 – СООН |
маргариновая |
гептадекановая |
|
|
СН 3 – (СН 2) 15 – СН 2 – СООН |
стеариновая |
октадекановая |
|
|
СН 3 – (СН 2) 17 – СН 2 – СООН |
арахиновая |
эйкозановая |
|
|
СН 3 – (СН 2) 19 – СН 2 – СООН |
бегеновая | ||
|
СН 3 – (СН 2) 21 – СН 2 – СООН |
лигноцериновая | ||
|
СН 3 – (СН 2) 23 – СН 2 – СООН |
церотиновая | ||
|
СН 3 – (СН 2) 25 – СН 2 – СООН |
монтановая | ||
|
СН 3 – (СН 2) 27 – СН 2 – СООН |
мелиссиновая | ||
Нумерацию цепи начинают от карбоксильной группы:
СН 3 – СН – СН 2 – СН – С = О
СН 3 СН 3 ОН
2,4-диметилпентановая кислота
Кислотные остатки некоторых карбоновых кислот также имеют свои индивидуальные названия.
Изомерия карбоновых кислот
1. Изомерия радикала
СН 3 – СН 2 – СН 2 – С = О СН 3 – СН – С = О
ОН СН 3 ОН
бутановая кислота 2-метилпропановая кислота
(масляная) (изомасляная)
2. Межклассовая изомерия со сложными эфирами
СН 3 – СН 2 – СН 2 – С = О СН 3 – СН 2 – С = О
ОН О – СН 3
бутановая кислота метиловый эфир пропановой кислоты
Физические свойства карбоновых кислот
Низшие представители карбоновых кислот (С 1 – С 3) – легкоподвижные жидкости с острым кислотным запахом, способные кристаллизоваться при охлаждении. С водой смешиваются во всех соотношениях. Начиная с масляной кислоты (С 4) – маслянистые жидкости, ограниченно растворимые в воде. Высшие кислоты (> С 10) – вещества твердые, не растворимые в воде, запаха не имеют. Все карбоновые кислоты растворимы в органических растворителях.
В классе кислот, так же как и в классе спиртов, встречается явление ассоциации молекул за счет образования водородных связей причем эти связи более прочные, чем в спиртах.
Таблица 16.5.
Показатели пожарной опасности предельных карбоновых кислот
|
Плотность |
t вспышки |
t самовосп | ||||
|
Муравьиная НСООН | ||||||
|
Уксусная СН 3 СООН | ||||||
|
Пропионовая СН 3 – СН 2 –СООН | ||||||
|
Масляная СН 3 – (СН 2) 2 – СООН |
Муравьиная кислота в свободном виде встречается в организме и едких выделениях муравьев, жгучей крапиве и в небольших количествах в моче и поте животных. Муравьиная кислота – едкое вещество: капли ее вызывают на коже пузыри.
Уксусная кислота известна в виде уксуса с глубокой древности. Безводная уксусная кислота может существовать в твердом состоянии в виде прозрачной массы или кристаллов, напоминающих лед, с температурой плавления 16,6 0 С. Поэтому безводную уксусную кислоту часто называют ледяной уксусной кислотой .
Масляная кислот в свободном состоянии содержится в прогоркшем масле и поте. Сложный эфир глицерина и масляной кислоты входит в состав коровьего масла. Так как другие жиры не содержат эфиров масляной кислоты, то в сомнительных случаях для доказательства подлинности коровьего масла производят анализ продукта на масляную кислоту.
Валериановая кислота содержится в валериановом корне, и в виде сложного эфира является компонентом лекарства валидола.
В названиях трех последующих четных кислот – капроновая, каприловая и каприновая есть общий корень. “Капра” по латыни – “коза”; эти кислоты действительно содержатся в жире козьего молока.
Пеларгоновая кислота содержится в летучем масле пеларгонии розовой и других растений семейства гераниевых, лауриновая кислота (в старых книгах ее называли лавровой) – в лавровом масле. Миристиновая кислота содержится в ароматных семенах мускатного дерева – мускатном орехе. Пальмитиновую кислоту выделяют из пальмового масла, выжимаемого из ядер кокосовых орехов. “Стеар” по-древнегречески означает “жир, сало”. Отсюда название стеариновой кислоты. Вместе с пальмитиновой она относится к наиболее важным жирным кислотам и составляет главную часть большинства растительных и животных жиров. Арахиновая кислота встречается в масле земляного ореха – арахиса.
Способы получения карбоновых кислот
1. Карбоновые кислоты встречаются в свободном виде в природе, так и в виде своих производных, например, сложных эфиров. Из сложных эфиров карбоновые кислоты могут быть получены гидролизом.
2. Окисление альдегидов (спиртов)
СН 3 – СН 2 – С = О + [O]СН 3 – СН 2 – С = О
пропаналь пропановая кислота
3. Промышленный способ – окисление предельных углеводородов
СН 4 + О 2 Н – С = О
ОН муравьиная кислота
Аналогично окислением алканов получают другие кислоты.
4. Муравьиную кислоту получают из оксида углерода (II).
СО + NaOHHCOONa
формиат натрия
HCOONa+H 2 SO 4 HCOOH+Na 2 SO 4
муравьиная кислота
5. Получение уксусной кислоты из оксида углерода (II) и метанола
СН 3 ОН + СОСН 3 СООН
метанол уксусная кислота
6. Карбонилирование алкенов
СН 3 – СН = СН 2 + СО + Н 2 ОСН 3 – СН 2 – СН 2 – С = О
пропен ОН
бутановая (масляная) кислота
Химические свойства карбоновых кислот
1. Свойства гидроксильного водорода
1.1. Взаимодействие с активными металлами:
2СН 3 – СН 2 – С = О + 2Na 2СН 3 – СН 2 – С = О +H 2
1.2. Взаимодействие с основными оксидами (металлов I –II групп):
2СН 3 – СН 2 – СООН + СаО (СН 3 – СН 2 – СОО) 2 Са +H 2 О
пропановая кислота кальциевая соль пропановой кислоты
1.3. Взаимодействие со щелочами:
СН 3 – СН 2 – СООН + КОН СН 3 – СН 2 – СООК +H 2 О
пропановая кислота калиевая соль пропановой кислоты
1.4. Взаимодействие с карбонатом натрия – качественная реакция на карбоксильную группу (выделение углекислого газа).
СН 3 – СН 2 – СООН +Na 2 СО 3 СН 3 – СН 2 – СООNa+H 2 О +CO 2
пропановая кислота натриевая соль пропановой кислоты
2. Свойства гидроксильной группы
2.1. Взаимодействие со спиртами – реакция этерификации – образование сложных эфиров:
Н 2 SO 4 конц.
СН 3 – СН 2 – С – ОН + ОН – СН 2 – СН 3 СН 3 – СН 2 – С – О– СН 2 – СН 3 + Н 2 О
пропановая кислота этанол этиловый эфир пропановой кислоты
(этилпропаноат)
3. Взаимодействие с галогенами. Происходит замещение атома водорода у второго углеродного атома цепи (в -положении).
СН 3 – СН 2 – С – ОН +Br 2 СН 3 – СН – С – ОН + НBr
пропановая кислота 2-бромпропановая кислота
(-бромпропионовая кислота)
4. Реакции окисления. Полное окисление – горение:
С 3 Н 6 О 2 + 3,5О 2 3СО 2 + 3Н 2 О
5. Особые свойства муравьиной кислоты
Восстанавливающие свойства муравьиной кислоты обусловлены наличием альдегидной группы
При окислении муравьиной кислоты образуется угольная кислота, которая разлагается на углекислый газ и воду:
Н – С = О + [О] Н 2 СО 3 Н 2 О + СО 2
Восстанавливающими свойствами муравьиной кислоты пользуются на практике для ее открытия (и отличия от других кислот).
Применение предельных карбоновых кислот
Наибольшее промышленное значение имеют муравьиная и уксусная кислоты.
Муравьиная кислота применяется в медицине (1,25 %-ный спиртовой раствор) как раздражающее средство при лечении ревматизма. Муравьиная кислота используется в больших количествах в ряде отраслей промышленности в качестве восстановителя, а также как наиболее сильная органическая кислота.
Уксусная кислота применяется в быту, в пищевой промышленности (например, для консервирования пищевых продуктов), для получения сложных эфиров для парфюмерной, медицинской промышленности, производства полимеров и ядохимикатов.
Широко используются соли уксусной кислоты. Разбавленные растворы уксуснокислого свинца (чрезвычайно ядовитое соединение) используются в медицине в виде свинцовых примочек. Уксуснокислые соли железа, алюминия и хрома имеют большое значение в текстильной промышленности для так называемого протравного крашения.
Основная уксуснокислая медь СН 3 СОО(CuОН) часто называется ярь-медянкой и применяется как зеленая краска.
Фторацетат натрия СН 2 F – COONa и фторацетат бария
(CH 2 F – COO) 2 Ba обладают высокой токсичностью, особенно для грызунов (крыс), и применяются поэтому для их истребления – дератизации.
